Прежде чем выйти на рынок или быть испытанным на человеке, любое вещество, будь то лекарственный препарат или косметическое средство, должно пройти тестирование на животных. В связи со вступлением в силу в странах Европейского Союза новых законов, запрещающих такие тесты, возникает вопрос: кто или что может адекватно их заменить, например, в доклинических исследованиях.
Наиболее перспективными здесь уже общепризнанны биочиповые технологии, которые можно объединить под названием «лаборатория-на-чипе» или «человек-на-чипе». Речь идёт об устройствах - микробиореакторах, в которых функционируют миниатюрные клеточные модели различных органов и тканей человеческого тела. Они взаимосвязаны друг с другом через сеть микроканалов – аналогов кровеносных сосудов. То есть, испытывая токсичность того или иного вещества на уменьшенной модели, можно получить информацию о его влиянии на реальный человеческий организм.
Такой подход к решению проблемы доклинических исследований не только может поднять уровень эффективности и прогнозирования для человека, - у него есть шансы существенно снизить риски побочных эффектов.
Разработкой технологии «человек на чипе» занимаются научно-исследовательские группы в Европе, США и России. Молодая российская компания Научно-технический центр «БиоКлиникум», входящая в европейский консорциум AXLR8, уже добилась успехов в области биочиповых разработок. Корреспондент Pro Science встретился с генеральным директором НТЦ «БиоКлиникум», выпускником химического факультета МГУ им. М.В. Ломоносова, кандидатом биологических наук Дмитрием Сахаровым.
Расскажите о том, как появилась идея создания технологии «человек-на-чипе» в мире и у вас.

Дмитрий Сахаров: Основа микробиореактора – это живые эукариотические клетки, на которых тестируют действие веществ. Со статическими клеточными монокультурами (один тип клеток) работают уже давно. Прежде всего – это раковые клетки. Примерно 10 лет назад начало параллельно развиваться сокультивирование нескольких линий и 3D-культуры. Сейчас исследователи стремятся найти клеточные линии, которые максимально приблизятся к нормальной клетке по функциональной активности.
Например, раньше активно работали с линией гепатоцитов HepG2 и она показывала 30% от активности реального гепатоцита (клетки печени). Сейчас уже разработана линия HepaRG, которая демонстрирует 70%. В разных научных сообществах обсуждается, насколько эти клетки могут быть названы аналогами реальных гепатоцитов, и всё чаще учёные сходятся во мнении, что по набору метаболических процессов это вполне адекватное подобие натуральной печени.
Сейчас по всему миру исследователи работают над созданием клеточных моделей и других органов и тканей (в организме человека их около 220): для кожи, кишечника, эндотелия сосудов, мозга, лёгкого и прочего. С появлением всё большего числа таких моделей появилась идея их объединения в одной системе, в одном миниатюрном организме. Например, чтобы препарат мог быть введен в циркуляцию через клетки кишечника, затем попал в клетки печени, где прошел его метаболизм, и продукты метаболизма уже попадали в органы-мишени. Лет 5 назад начали появляться первые публикации о технологиях под общим названием «человек-на-чипе». Сейчас в мире существует несколько групп, которые создают микромодели разных органов и их комбинаций.
Именно к таким устройствам и относится наш вариант технологии «человек-на-чипе» - «Гомункулус». Изначально этот проект зародился в Техническом университете Берлина в Германии (Technische Universität Berlin), и примерно 5 лет назад мы подключились к нему, с одной стороны, со своими инженерными разработками, с другой стороны – с клеточными. На первом этапе произошёл трансфер технологий, когда немецкие коллеги передали нам все имевшиеся на тот момент у них разработки и патенты, далее проект начал двигаться параллельно.

Работа ведётся на паритетных началах со всеми необходимыми договорами. Что касается технического оснащения: теперь наши немецкие коллеги заказывают приборы у нас, а не в Дрездене, как это было ранее. Сейчас у них стоит 8 наших машин. За короткий промежуток времени, около полутора лет, в сотрудничестве нам удалось создать уникальный прибор с высокими техническими характеристиками. Сейчас мы занимаемся получением сертификата для того, чтобы его можно было использовать в России как прибор медицинского назначения, также происходит патентование некоторых отдельных его узлов и технологий.
В России мы в данном направлении пионеры, а в Европе «человеком-на-чипе» занимаются четыре группы. И, как показали последние конференции, прошедшие в Берлине (AXLR8-3) и Линце (EUSAAT 2012), мы не только не уступаем нашим западным коллегам, но и опережаем их в технической части после выхода прибора последнего поколения. Это стало возможным в первую очередь благодаря сочетанию в одном коллективе молодых талантливых математиков, физиков, химиков и инженеров.
Путь от идеи в голове нескольких учёных до автономной спин-офф компании - оказался сложным?
Дмитрий Сахаров: У нас под научным руководством члена-корреспондента РАН д.б.н. Александра Григорьевича Тоневицкого возникла амбициозная идея - пойти по европейской модели развития науки. Это когда фундаментальные разработки крупных институтов передаются спин-офф компании, которая их коммерциализирует, осуществляет дополнительные самостоятельные разработки и внедряет на рынок новый продукт или технологию. В российских реалиях такая схема пока редко возникает, поэтому у нас было желание попробовать, и в конце 2008 года была основана фирма БиоКлиникум.
До 2010 года она существовала в зачаточном состоянии - не было ни больших грантов, ни крупных проектов. Осознание перспектив развития БиоКлиникум и бурный рост пришлись на 2011 год, тогда мы начали собирать в штат биологов, химиков, биофизиков и математиков из ведущих российских вузов. К началу 2012 года мы выиграли довольно крупный грант на опытно-конструкторские разработки от министерства образования и науки, и только тогда смогли собраться в одном месте из разных московских институтов.
Сейчас у нас сформировалась частная автономная лаборатория полного цикла: фундаментальные научно-исследовательские разработки, опытно-конструкторские разработки, производство и внедрение. На данный момент у нас в штате около 35 человек. Это и учёные, и инженеры, и административный персонал – все в одном месте под одной крышей. Научным руководителем БиоКлиникум является член-корр РАН А.Г. Тоневицкий. Разумеется, мы работаем не в вакууме, у нас есть ряд партнёров - как в России, так и в Европе.
В каких направлениях ведётся работа в БиоКлиникум в настоящее время?
Д.С.: Сейчас основные направления задаются двумя большими грантами Минобрнауки в рамках федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007—2013 годы». Это микробиореактор «Гомункулус» (Homunculus), а также тест-системы в онкологии.

Микробиореактор позволяет осуществлять длительное сокультивирование клеточных культур (моделей органов и тканей). При этом - с тонким мониторингом их состояния, которое дает возможность проводить тестирование веществ различного назначения для выявления их возможного действия на организм человека. А тест-системы в онкологии – это анализ транскриптома удаленной опухоли, построение путей и сетей взаимодействий генов, поиск генов-кандидатов, ответственных за молекулярно-генетические особенности опухоли, влияющие на выживаемость пациента после операции. Оба проекта прорывные, и в этом наша сила.
В глобальной перспективе мы будем сводить их в один, посвящённый персонализированному подходу в лечении онкологических заболеваний. Мы планируем на основе биопсии опухоли пациента и дальнейшем культивировании выделенных раковых клеток в микробиореакторе помогать в подборе индивидуального лечения, так называемая концепция exvivo подбора терапии.
Для «Гомункулуса» параллельной задачей будет оставаться скрининг новых фармацевтических препаратов, поиск лекарств-кандидатов, оценка их безопасности и эффективности на клеточных моделях органов и тканей человека.
Клеточные модели каких органов вы используете в «Гомункулусе»?
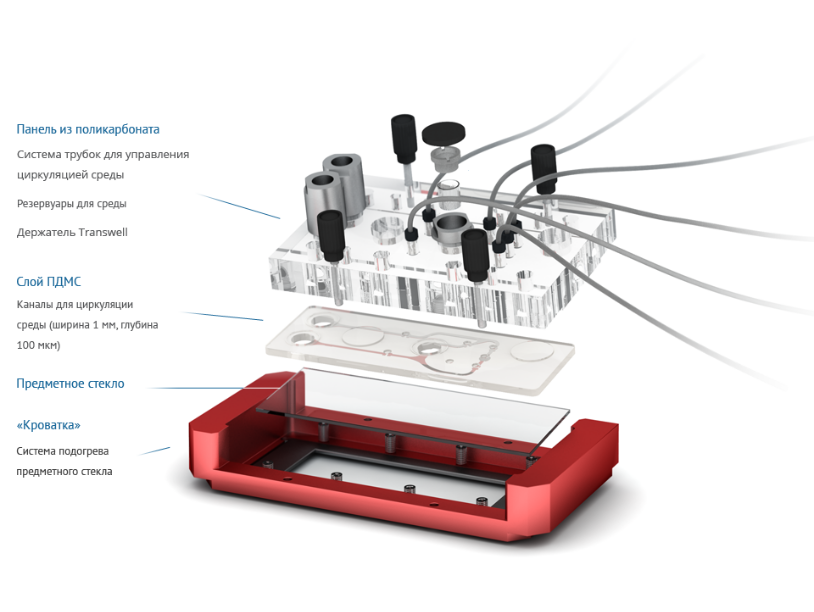
Д.С.: Мы сосредоточились на кишечнике, печени, коже и мозге. В разработке находится эндотелий сосудов. Для более широкого спектра у нас, к сожалению, пока не хватает людских ресурсов, поскольку каждая клеточная модель – это серьёзная научная задача и трудоёмкий процесс. Последний вариант нашего чипа позволяет культивировать 6 клеточных моделей. Здесь точно будет печень, кишечник, мозг, кожа, возможно, появится ещё почка, поскольку это очень важный функциональный орган для выведения продуктов жизнедеятельности организма. Понятно, что невозможно ввести в строй сразу 220 моделей органов и тканей, поскольку в такой системе просто невозможно будет что-либо понять.
При создании своего чипа мы по сути уменьшили организм человека в 100 000 раз. То есть у нас количество клеток меньше в 100 000 раз, количество жидкости меньше в 100 000 раз, пропорционально снижена скорость циркуляции жидкости, то есть мы стараемся с биологической точки зрения остаться в рамках нормальной физиологии. Даже наш насос на чипе сконструирован таким образом, чтобы создавать небольшое сжатие-растяжение клеток, как это происходит при пульсировании крови от сердечных сокращений.
Чем ваш прибор принципиально отличается от немецкого аналога? Чем он лучше?
Д.С.: Каждый наш прибор удовлетворяет всем требованиям к ультрасовременному научно-исследовательскому оборудованию. Он рассчитан на 4 чипа (параллельные эксперименты), оснащён большим графическим дисплеем (удобство управления), есть система термостатирования чипа и подачи СО2 (поддержание заданных условий эксперимента), а также датчики контроля за жизнью клеток. Прибор последнего поколения оснащён большим количеством всевозможных современных «фишечек». Например, это оповещение по SMS и E-mail о неполадках, подключение и управление через Интернет. То есть, если проводится длительный эксперимент, исследователю не обязательно круглые сутки находиться в лаборатории – он может отчасти следить за работой и с удаленного компьютера.
Чего удалось достичь помимо прогрессивной конструкции прибора? Есть ли какие-то серьёзные научные результаты на данный момент?
Д.С.: Сейчас в профильном журнале Lab on chip готовятся к выходу 3 наших публикации на тему «Гомункулуса» - это обзор, описание технологии и описание эксперимента, который мы провели. Можно сказать, что в основном работа по самому прибору завершена, возможны только некоторые небольшие доработки. Сейчас мы сосредоточились на применении «Гомункулуса» при тестировании различных лекарственных препаратов, чтобы понять его возможности. И, пожалуй, одним из самых важных здесь вопросов является валидность нашего микробиореактора. Другими словами, необходимо понять, насколько он способен «быть человеком» и отражать живой организм.
Для этого было решено посмотреть, как откликнутся наши клеточные модели на определённый препарат, действие которого на организм животного и человека хорошо изучено. С этой целью было выбрано противодиабетическое средство – троглитазон, которое вышло на рынок в 1997 году и в 2002 снято, поскольку обнаружилась его токсичность для печени. Тогда было выявлено 600 случаев развития цирроза и множество случаев менее тяжёлых последствий, которые не вскрылись при доклинических испытаниях.
Мы проверили его на чипе, содержащем клетки печени и эндотелия сосудов, в качестве нейтральной ткани была кожа. В ходе эксперимента мы увидели процесс разрушения клеток печени и ряд более глубоких процессов – при том, что остальные две ткани не страдали. Результат был ожидаем, и «Гомункулус» в полной мере себя оправдал.
Этот пример наглядно иллюстрирует, что анализ того или иного препарата на животных не всегда гарантирует безопасность для человека. Разумеется, мы не претендуем на истину в последней инстанции, и микробиореатор стоит рассматривать всё-таки как дополнение к исследованиям на животных.
К сожалению, случай с троглитазоном не единственный. Известен печальный опыт клинического тестирования иммуномодулятора TGN 1412. Доклинические испытания на животных показали прекрасные результаты. Препарат долгое время тестировали на мышах, крысах, кроликах, собаках и обезьянах. Однако во время первой стадии клинических испытаний на 10 абсолютно здоровых добровольцах спустя несколько часов после приёма препарата у всех них развилась мультиорганная недостаточность, закончившаяся для двоих инвалидностью. Препарат вызвал прямо противоположную реакцию организма человека – бешеный иммунный ответ. Стоит отметить, что добровольцам ввели всего одну пятисотую дозы, опробованной на животных. Оказалось, что всё дело в особом типе клеточных рецепторов, которые присутствуют у человека и отсутствовали у подопытных животных. Данный пример подтверждает необходимость создания комплексных invitro методик тестирования безопасности препаратов с использованием моделей органов и тканей человека. Известно, что новые лекарственные средства, так называемые дизайнерские лекарства (designer drug) обладают высокой специфичностью к человеческому организму, и оценивать их эффективность и безопасность на животных моделях не всегда возможно.
Не менее важной задачей для «Гомункулуса» также является поиск новых лекарственных препаратов перед началом доклинических исследований, когда из 10 тысяч кандидатных веществ 1000 проходит в доклинические исследования, 10 - в клинические, и 1 вещество выходит на рынок. Микробиореактор максимально увеличит эффективность этого отбора и поможет не пропустить в доклинические испытания откровенно ненужные препараты, и одновременно не отмести вещества, которые окажутся полезными при клинических испытаниях. Такой подход позволит существенно сократить затраты при поиске новых лекарственных средств.
Способен ли микробиореактор полностью вытеснить подопытных животных, или что-то остаётся исключительно за «мышами»?
Д.С.: Я бы не был столь категоричен. Всё-таки микробиореактор – это скорее дополнение, может быть, именно для доклинического тестирования. Например, по европейским требованиям для испытания безопасности одного вещества необходимо около 10 000 животных. «Гомункулус» и другие микробиотехнологии – это значительная экономия, в том числе и в длительной перспективе. Большой эффект будет на стадии отбора лекарств-кандидатов.
Кроме того, от научно-исследовательской разработки препарата до выхода на рынок проходит около 25 лет. Здесь огромный ярус занимают доклинические и клинические исследования. Даже если удастся сократить этот период хотя бы на 2-3 года – это уже большое достижение и снижение затрат.
